タンパク質が生体内で機能するには、ねじれた複雑な立体構造である「フォールド」を形成することが重要です。ELSIの研究者らは、フォールドがタンパク質の進化の過程において、いつどのように出現したのかを調べるために、最も古いタンパク質ファミリーの1つから始原タンパク質を合成し、電子常磁性共鳴(EPR)法によって解析しました。その結果、折り畳みの出現はペプチドとRNAの相互作用によって形成される小さな液滴によって促進されることが示されました。
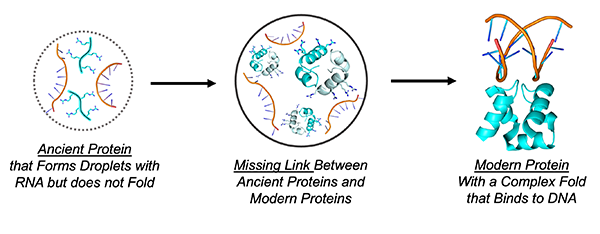
生物の体の中では、さまざまなタンパク質が働いています。タンパク質は何千もの原子が連結し、複雑に折り畳まれた立体構造をもっていますが、このフォールドと呼ばれる複雑な構造が生体内での機能に大きく関係しています。タンパク質の折り畳みの形状については精力的な研究が行われていますが、折り畳み構造の進化的起源の多くはいまだに解明されていません。
東京工業大学 地球生命研究(ELSI)のLiam Longo 特任准教授、Daniella Goldfarb 教授(ワイツマン科学研究所:イスラエル)、Norman Metanis 教授(ヘブライ大学:イスラエル)らの研究グループは、単純なペプチドとRNAを混ぜ合わせてできたコロイドゾルから成る液滴の中で、折り畳み構造が出現したという仮説を立てました。このような液滴は、コアセルベートと呼ばれ、生化学者Oparinによって地球の生命の発生の初期段階として提唱されるなど、生命進化の研究において注目を集めています。しかしながら、タンパク質の構造の進化におけるコアセルベートの役割は、ほとんど知られていません。
タンパク質の進化の歴史は、40億年近く前までさかのぼります。研究グループは進化の初期のタンパク質を研究するために、モデルシステムを構築することにしました。まず、地球上のすべての生物に存在し、最も古いタンパク質ファミリーの1つであることが示唆されているタンパク質ファミリーを特定しました。このタンパク質ファミリーのすべての既知の配列を手に入れ、数学的進化モデルを用いることで、先祖のタンパク質を「復活」させることができました。さらに、最終的に得られた「祖先配列」を、進化の後期のみに出現した複雑な化学基を削除するなどして単純化しました(図2)。
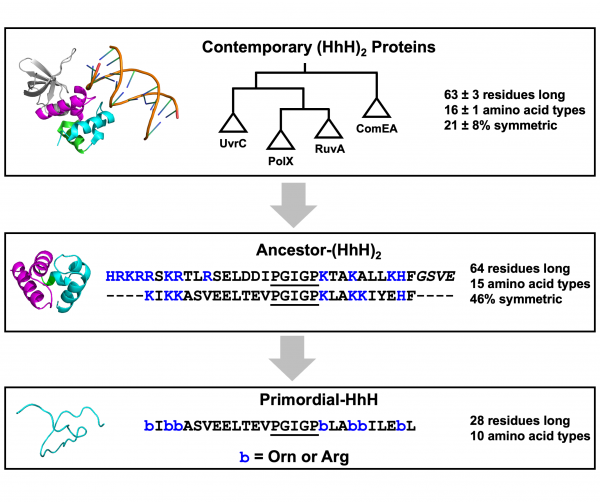
得られた配列から、モデルとなる原始タンパク質を合成しました。原始タンパク質とRNAを混合したときに形成される液滴内で、タンパク質がどのような形をとるかを調べるために、研究グループは電子常磁性共鳴(EPR)法と呼ばれる技術に着目しました。EPR法を用いれば、対になっていない電子の挙動を観察することで、液滴内部のタンパク質の立体構造のダイナミクスを知ることができます。
実験の結果、液滴の外側では、原始タンパク質のほとんどが折りたたまれていない状態で観察されました。非常に単純な原始タンパク質の配列は構造化されにくいため、これは驚く結果ではありません。しかし、液滴の中の原始タンパク質には、折り畳みの強い痕跡が観察されました。非常に高濃度のRNAとペプチドによって引き起こされる液滴内の特異な条件が、タンパク質の折り畳みの達成を促進していたのです。液滴ができることで、それまで折り畳みができなかったタンパク質が複雑な構造をとることができるようになり、初期の生命の誕生に貢献した可能性が示唆されました。
単純な構造がどのようにして複雑化していったのか、その過程を理解することは、分子進化の研究の大きな課題の1つです。RNAとタンパク質から成る液滴が、新しいタンパク質構造の実験場になり得るというこの発見は、生物が最初のタンパク質の折り畳みをどのように成し得たかを研究者に教えてくれます。液滴は生命の起源を研究する上で非常に興味深い研究対象ですが、今回の結果は、液滴の重要性がこれまで知られていた以上に大きいことを示しています。
| 掲載誌 | Journal of the American Chemical Society |
| 論文タイトル | Peptide-RNA Coacervates as a Cradle for the Evolution of Folded Domains |
| 著者 | Manas Seal1, Orit Weil-Ktorza2, Dragana Despotović3, Dan S. Tawfik3, Yaakov Levy4, Norman Metanis2,5,6, Liam M. Longo7,8,*, and Daniella Goldfarb1,* |
| 所属 | 1. Department of Chemical and Biological Physics, Weizmann Institute of Science, Rehovot 7610001, Israel 2. Institute of Chemistry, The Hebrew University of Jerusalem, Jerusalem 9190401, Israel 3. Department of Biomolecular Science, Weizmann Institute of Science, Rehovot 7610001, Israel 4. Department of Chemical and Structural Biology, Weizmann Institute of Science, Rehovot 7610001, Israel 5. Casali Center for Applied Chemistry, The Hebrew University of Jerusalem, Jerusalem 9190401, Israel 6. The Center for Nanoscience and Nanotechnology, The Hebrew University of Jerusalem, Jerusalem 9190401, Israel 7. Earth-Life Science Institute, Tokyo Institute of Technology, Tokyo 152-8550, Japan 8. Blue Marble Space Institute of Science, Seattle, Washington 98104, United States |
| DOI | 10.1021/jacs.2c03819 |
| 出版日 | 2022年7月29日 |
